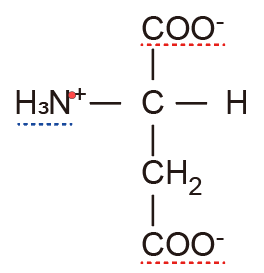
アスパラギン酸の場合-01
アスパラギン酸

側鎖もイオン化する可能性があります.
グリシンと同様に,二つの方法で解いていきましょう.
平衡反応
グリシンは側鎖も電離しますので,四つの平衡状態をとると考えられます.
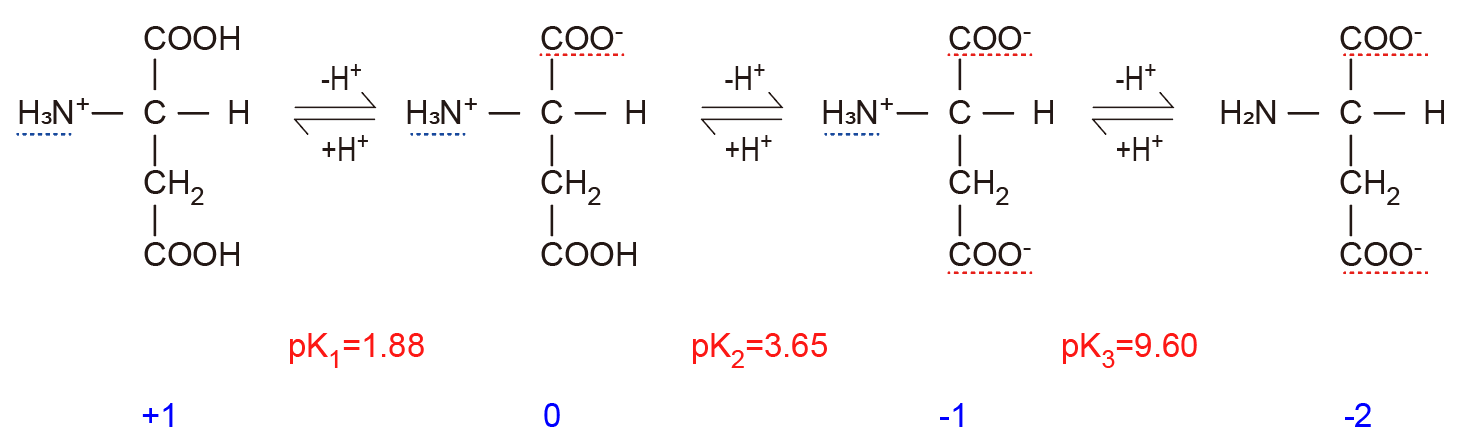
N+RC N+RC- N+R-C- NR-C-
A B C D
アミノ基のイオン化,カルボキシル基のイオン化により三つ状態,電荷は+1,0,-1,-2と取ります.
その際の平衡定数は,pK値から計算できます.
また,簡便に,N+RC,N+RC-,N+R-C-,NR-C-,もしくは,A, B, C,Dとおきましょう.
各反応の平衡定数は,
\(\Large K_1 = \frac{N^+ R C^- \cdot H^+}{N^+ R C} = \frac{B \cdot H}{A} \)
\(\Large K_2 = \frac{N^+ R^- C^- \cdot H^+}{N^+ R C^-} = \frac{C \cdot H}{B} \)
\(\Large K_3 = \frac{N R^- C^- \cdot H^+}{N^+ R^- C^-} = \frac{D \cdot H}{C} \)
となります,従って,
\(\Large A = \frac{B \cdot H}{K_1} = \frac{D \cdot H^3}{K_1 K_2 K_3} \)
\(\Large B = \frac{C \cdot H}{K_2} = \frac{D \cdot H^2}{K_2 K_3} \)
\(\Large C = \frac{D \cdot H}{K_3} \)
とDで置き換えることができます.
また,
\(\Large A + B + C + D = 1 \)
となりますので,
\(\Large \frac{D \cdot H^3}{K_1 K_2 K_3} + \frac{D \cdot H^2}{K_2 K_3} + \frac{D \cdot H}{K_3} + D = 1 \)
とすることができ,
\(\Large D = \frac{1}{\frac{ H^3}{K_1 K_2 K_3} + \frac{ H^2}{K_2 K_3} + \frac{ H}{K_3} + 1 } \)
\(\Large C =\frac{H}{K_3} \frac{1}{\frac{ H^3}{K_1 K_2 K_3} + \frac{ H^2}{K_2 K_3} + \frac{ H}{K_3} + 1 } \)
\(\Large B = \frac{H^2}{K_2 K_3} \frac{1}{\frac{ H^3}{K_1 K_2 K_3} + \frac{ H^2}{K_2 K_3} + \frac{ H}{K_3} + 1 } \)
\(\Large A = \frac{H^3}{K_1 K_2 K_3}\frac{1}{\frac{ H^3}{K_1 K_2 K_3} + \frac{ H^2}{K_2 K_3} + \frac{ H}{K_3} + 1 } \)
と書き換えることができます.
電荷
ここで電荷が0になるには,
A:+1 B:0 C:-1 D:-2
であるから,A=C+2D となればいいので,
\(\Large \frac{H^3}{K_1 K_2 K_3}\frac{1}{\frac{ H^3}{K_1 K_2 K_3} + \frac{ H^2}{K_2 K_3} + \frac{ H}{K_3} + 1 } = \frac{H}{K_3} \frac{1}{\frac{ H^3}{K_1 K_2 K_3} + \frac{ H^2}{K_2 K_3} + \frac{ H}{K_3} + 1 } + \frac{2}{\frac{ H^3}{K_1 K_2 K_3} + \frac{ H^2}{K_2 K_3} + \frac{ H}{K_3} + 1 } \)
となり,共通の分母はキャンセルし合って,
\(\Large \frac{H^3}{K_1 K_2 K_3} = \frac{H}{K_3} + 2 \)
\(\Large H^3 - K_1 K_2 \cdot H - 2 K_1 K_2 K_3 = 0 \)
を解けばいいのです.
しかし...この三次方程式を解くのは...難しい..ということでMathematicaを用いて解くと,
\(\Large H = -0.00171791 \)
\(\Large pH = -log H = 2.765 \)
となります.
Mathematicaでの解法
Mathematicaにおいては,
pK1=1.88;
pK2=3.65;
pK3=9.60;
K1=10^(-pK1);
K2=10^(-pK2);
K3=10^(-pK3);
a=-K1*K2;
b=-2*K1*K2*K3;
sol=Solve[x^3+a*x+b==0,x]
で三次方程式を解きます,その結果を,
-Log10[x]/.sol[[1]]
でpHが計算できます.
Wolfram Alphaでの解法
Wolfram AlphaはMathematicaと同じメーカーですが,無料でいろいろな計算を行ってくれます.
x^3-10^(-1.88)*10^(-3.65)*x-10^(-1.88)*10^(-3.65)*10^(-9.6)=0
と打ち込むと水素イオン濃度が出てきますので,pHに換算すればいいですね.
各電荷とpH
四つの状態のイオン状態の存在割合のpH依存性は,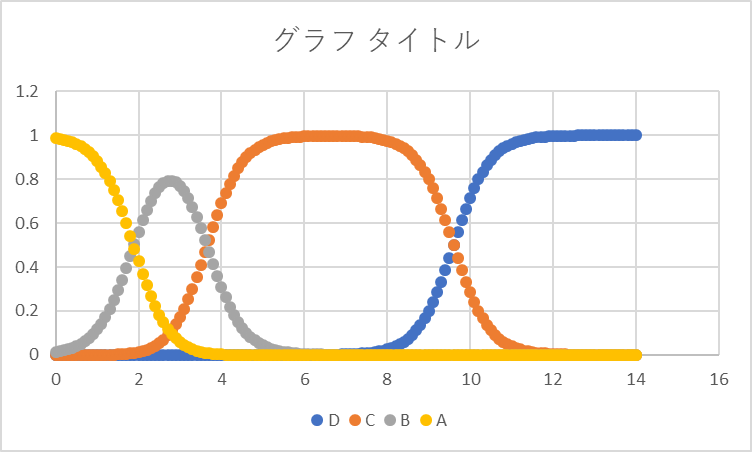
となって,pH=2.7近辺では,Dの割合はほとんど無いことがわかります.
これの総和は,
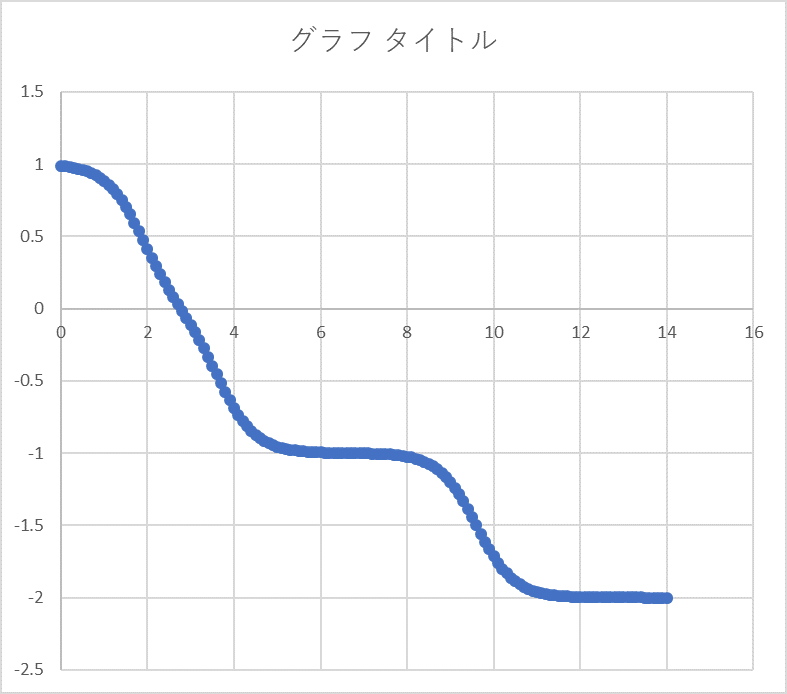
となってpH=2.7あたりで中和されていることがわかります.
次に,独立にそれぞれの基の解離を考えていきましょう.